新闻资讯
在人类的大脑中存在数以亿计的神经元,后者通过数万亿的突触组成复杂的神经网络。不同种类 的神经元通过近端或远程投射控制着一系列重要的生理活动,包括运动、感知、意识、情绪、学习和记忆等。神经元之间的交流主要依赖于化学突触,突触前神经元发放动作电位,位于突触前膜上电压依赖型的钙离子通道打开,并引起钙离子的内流,后者进一步导致突触小泡与突触前膜融合,并将小泡内的神经递质释放到突触间隙,神经递质与位于突触后膜的受体结合,引起下游神经元兴奋性的改变,最终实现神经元之间信号的转导。神经递质的正常释放对于维持机体正常的生理功能发挥着重要作用,同时,神经递质的释放与调节出现异常时也与一系列的病理过程相关,如抑郁症(Depression)、成瘾(Addiction)、帕金森氏症(Parkin鄄 son's disease,PD)和阿尔兹海默症(Alzheimer's disease,AD)等。 因此,在分子、细胞、环路等层面精 确地分析检测神经递质是如何参与并调节上述生理和病理过程,能够更深入地了解疾病的发病机制,并为临床药物的开发奠定基础。人类的大脑中存在上百种神经递质,包括氨基酸类神经递质(如谷氨酸 (Glu)、酌鄄氨基丁酸 (GABA))、单胺类神经递质(如多巴胺 ( DA)、去甲肾上腺素( NE)、五羟色胺 (5鄄HT))、胆碱类神经递质(如乙酰胆碱(ACh))、多肽类神经递质(如阿片肽、催产素)等。其中,大脑主要的兴奋性神经递质谷氨酸以及抑制性神经递质酌鄄氨基丁酸在突触前膜释放后,可快速地与位于突触后膜的离子型受体结合,并引起神经元兴奋性的改变。但对于多巴胺、催产素这类神经递质而言, 其受体主要是代谢型受体,即 GPCR,这类受体介导的信号转导相较于离子型受体时程更长、空间更广。不同种类的神经递质释放模式的复杂性、时间空间的差异、受体种类以及分布的不同,使得精确检测神经递质释放的难度大大增加,传统的电生理检测方法很难实现此目标。近年来,为了实现对神经递质释放的精确检测,已开发了包括生物化学和电化学等一系列检测方法。
微透析法
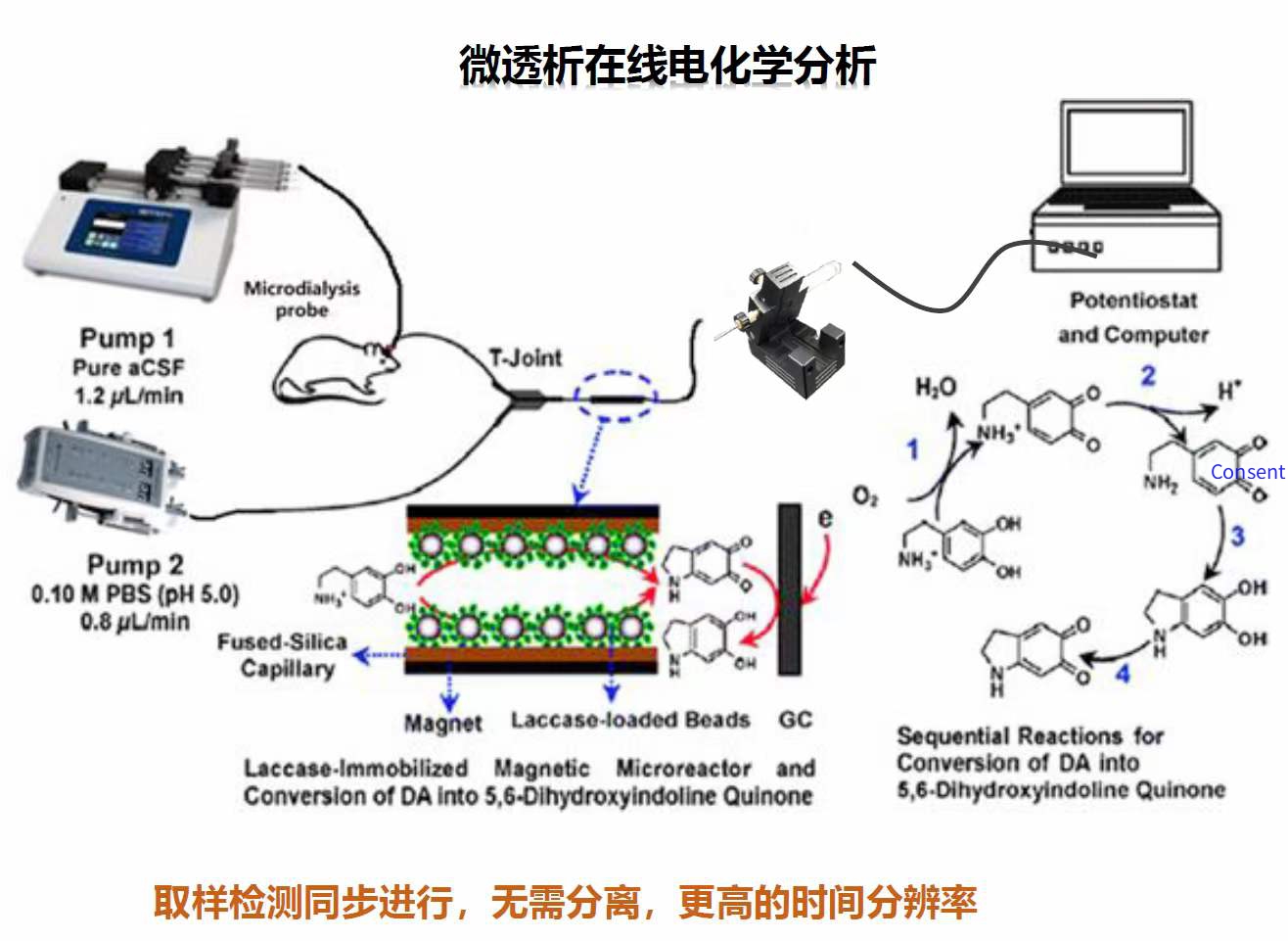
微透析法(Microdialysis)是一种对待测组织损伤相对较小、灵敏度较高的方法,被广泛用于检测大脑中的各种生物分子,包括神经递质、激素以及其它化学小分子的分布和动态变化过程。微透析系统含 有一个微透析探头,探头前端被半透的中空纤维膜覆盖,两端与人工脑脊液(Artificial cerebrospinal fluid, ACSF)的入口管和出口管相连。使用该系统检测大脑中神经递质的动态变化,首先要将微透析探 头插入待研究的脑区,并对该系统灌流 ACSF,使其以 0. 5 ~ 2. 0 滋L / min 的速度持续不断地通过微透析探头前端的半透膜,与大脑中的脑脊液进行物质交换,在此过程中,细胞外液中的神经递质通过被动扩散作用穿过半透膜进入ACSF, 之后回收透析液,利用高效液相色谱(High performance liquid chromatography,HPLC)或气相色谱(Gas chromatography,GC)将不同的神经递质分离出来,通过质谱 (Mass spectroscopy, MS) 分析脑脊液中每种神经递质的含量, 最终实现对神经递质的检测。由于此系统持续地对微透析探头灌流 ACSF,因此在样品采集位置很难建立神经递质的化学梯度平衡,导致透析液中的神经递质浓度低于采样位置的实际浓度。为了提高对采样位置神经递质浓度测量的准确度,可通过降低 ACSF 的灌流速度使其尽量建立平衡; 同时,为保证样品中神经递质的含量足够在后续系统中被检测出来,只能在一定程度上降低该系统的采样频率,导致该系统的时间分辨率较低。尽管微透析法可在复杂的神经系统中实现对各种神经递质相对精确、灵敏、长时程的检测,但由于其时间分辨率比较低,单次采样时间通常约10min,因此很难实时地检测大脑中快速变化的神经递质。


电化学法
除了利用微透析的方法检测神经递质浓度的变化,基于氧化还原反应原理的电化学检测方法近年 也逐步发展起来。安培法(Amperometry)被用于检测可被氧化还原的神经递质的动态变化。利用此 方法检测神经递质释放时, 需要将电极放置在被记录细胞表面附近,给予电极一个固定的电压,并保持该电压高于被检测神经递质的氧化还原电位。当神经递质从细胞释放并扩散至电极表面,会被氧化,进而发生电子的转移,通过电极记录到的电流指示神经递质的释放。最初,由于电极的直径过大,很难检测单个细胞的分泌反应,通过改进电极的尺寸、材料和记录方法,使得该方法可检测神经递质从单个突触小泡的释放。由于氧化还原反应非常迅速,该方法能够以毫秒级别的时间分辨率检测神经递质的动态变化。然而,安培法是基于氧化还原的原理开发的,因此只能用于检测易于被氧化还原的物质, 而对于乙酰胆碱等难以被氧化还原的神经递质则比较困难。此外,这种检测方法缺乏特异性,不能区分不同的神经递质,凡是可被特定电位氧化还原的物质均能产生电子,并被电极记录,因此,这种方法通常与HPLC 联用,实现神经递质的特异性检测。目前,此方法已被应用于检测肾上腺嗜铬细胞去甲肾上腺素的释放、肥大细胞五羟色胺的释放、活体大鼠伏隔核(Nucleus accumbens, NAc)内源多巴胺的释放等。快速扫描循环伏安法(Fastscan cyclic voltammetry,FSCV)是基于氧化还原反应原理的方法,被广泛用于检测可被氧化还原的神经递质的释放[21] 。FSCV与Amperometry 的区别在于FSCV 给予电极的是呈特定波形并不断变化的电压,而不是恒定的电压,不同的神经递质在不同的电压下发生氧化还原反应,并产生相对应的电流,因此,该方法相比于安培法的优势是可在一定程度上区分不同的神经递质,已被广泛用于小鼠脑片以及活体小鼠研究单胺类神经递质的释放。如Marcinkiewcz 等使用该方法在小鼠脑片上记录到大脑中缝背核(Dorsal raphe nucleus,DRN) 五羟色胺能神经元释放的五羟色胺;Saylor 等也成功地在活动小鼠的海马(Hippocampus)中记录到不同发情周期内五羟色胺的释放。虽然FSCV具有较高的时间分辨率和一定的神经递质分子的特异性,但难以实现对多个区域的同时检测。此外,虽然碳纤电极的直径可达到微米级别,但是依然难以精确定位到特定突触,很难实现亚细胞特异性检测。
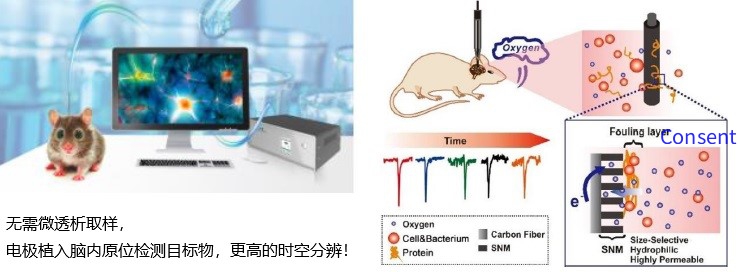
同一刺激下,原位微电极同时记录到5-HT及多巴胺的瞬间释放,且5-HT 持续过程更长。
神经递质作为大脑中一类重要的信息传递分子,参与了多种生理过程,神经递质的释放与调节出现异常时,可引发多种疾病。因此,精确地检测生理与病理过程中神经递质的释放与调控,可更好地理解某些疾病的发病机理,并为临床治疗奠定基础。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。
订购和售后

邮箱:consentcs@163.com
地址:湖南省长沙市高新技术开发区青山路699号湖南省军民融合科技创新产业园8栋B座1609室
微信公众号
Copyright © 康森特生物科技(长沙)有限公司 2024
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。

售前:+86-0731-84228665
+86 -180 7516 6076
售后:+86 -180 7516 7741
传真:+86-0731-84228665


