新闻资讯
11月6日,北京脑科学与类脑研究所罗敏敏实验室在Nature期刊发表题为“Adenosine Signalling Drives Antidepressant Actions of Ketamine and ECT”的研究成果。研究发现大脑中一种名为腺苷(Adenosine )的信号分子,是氯胺酮(Ketamine)与电休克疗法(ECT)产生快速抗抑郁作用的核心通路,并基于此提出“间歇性低氧干预方案”(aIH),实现安全、可控地诱发大脑内腺苷释放,从而达到显著抗抑郁效果。
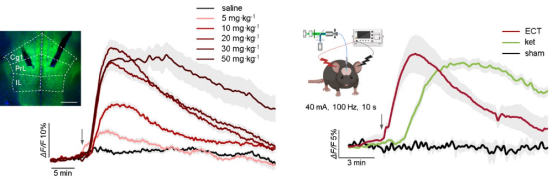
研究者首先利用基因编码的腺苷探针GRABado,通过光纤光度测量技术,在小鼠体内实现了对特定脑区细胞外腺苷浓度的实时动态监测。研究发现,在给予亚麻醉剂量的氯胺酮后,小鼠内侧前额叶皮层与海马体区域出现了快速且持续的腺苷水平升高,而伏隔核区域则未观察到类似变化。同样,在实施电休克治疗时也观测到了内侧前额叶皮层内类似的腺苷释放。
1、负性刺激和中性刺激激活LC→vLGN/IGL环路
研究人员通过光纤钙成像系统发现在足底电击、气喷、伤害性刺激、热刺激、悬尾实验等负性刺激vLGN/IGL神经元钙离子活性显著增加。在声音刺激、新物体刺激等中性刺激后上述神经元钙离子活性增加,但随着刺激次数增加,钙离子活性逐渐减弱。
逆行示踪病毒发现vLGN/IGL神经元主要接受来自于视网膜、上丘浅表层、视觉皮层、顶盖前区前核(APN)、中缝背核(DRN)、蓝斑(LC)。然而,当使用病毒工具特异性损毁这些输入通路后,只有损毁来自LC的输入,抑制由足底电击、伤害性刺激、声音及新物体刺激所引发的vLGN/IGL神经元钙活动增强。
在LC脑区注射cre依赖光激活病毒,vLGN/IGL脑区注射逆行cre病毒,待病毒表达后光刺激可引起vLGN/IGL脑区兴奋性突触后电流,α1-肾上腺素受体拮抗剂和AMPA受体拮抗剂均可阻断上述电流的产生,表明vLGN/IGL脑区的LC输入可共释放谷氨酸和去甲肾上腺素。钙成像记录到负性刺激和中性刺激均能显著增强投射至vLGN/IGL的LC神经元的钙离子活性。负性刺激和中性刺激可促进vLGN/IGL脑区谷氨酸和去甲肾上腺素的释放,然而仅AMPA受体拮抗剂可阻断负性刺激和中性刺激引起的vLGN/IGL神经元激活。

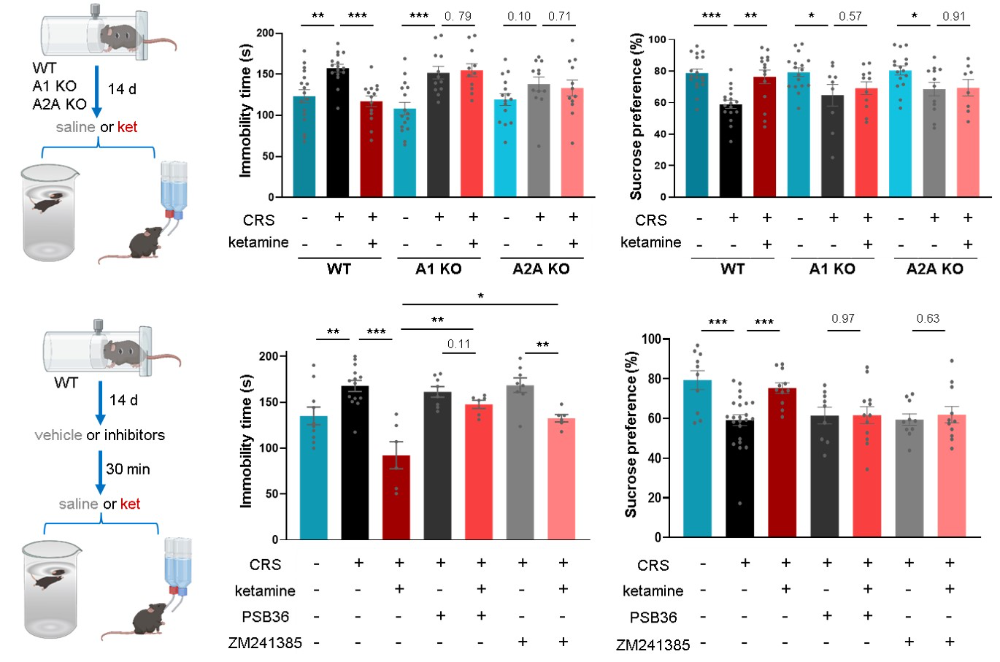
接下来,研究者通过遗传学与药理学手段,确证了腺苷信号对于抗抑郁效应的必要性。在腺苷A1受体或A2A受体基因敲除的小鼠中,氯胺酮与电休克治疗在强迫游泳实验和糖水偏好实验中所表现出的抗抑郁效应完全消失。在野生型小鼠中,系统性给予A1或A2A受体拮抗剂,同样能够阻断氯胺酮的抗抑郁作用。重要的是,受体敲除并不影响氯胺酮诱导的腺苷释放本身,也不影响其引起的运动亢进效应,表明腺苷信号通路特异性地介导了其治疗作用,而非特异性的行为效应
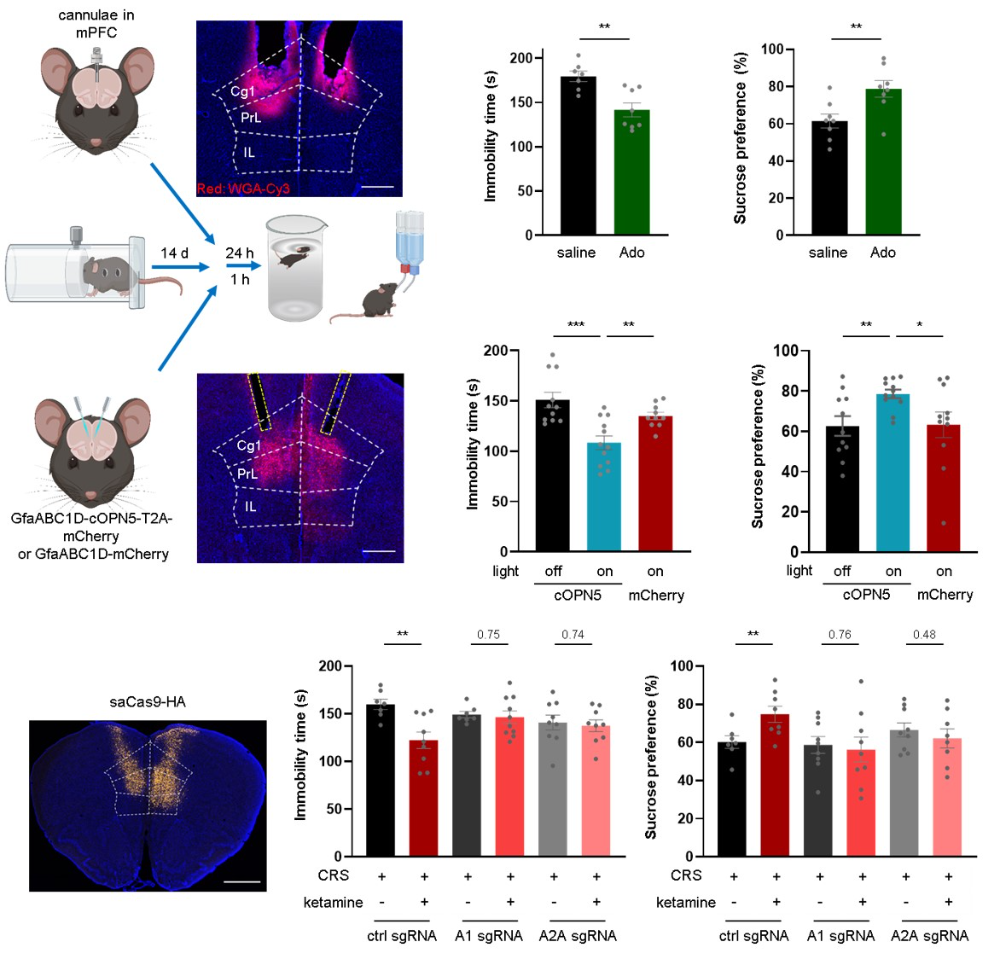
为进一步确定腺苷信号的作用脑区,研究者进行了环路层面的功能验证。实验发现,直接向内侧前额叶皮层内注射腺苷,或利用光遗传学技术特异性激活该区域的星形胶质细胞以诱导内源性腺苷释放,均足以在抑郁模型小鼠中产生快速的抗抑郁行为效应。相反,利用AAV介导的CRISPR/Cas9技术,特异性在内侧前额叶皮层敲低A1或A2A受体,则阻断了全身给予氯胺酮所产生的治疗效果。这些结果共同表明,内侧前额叶皮层是腺苷信号介导快速抗抑郁作用的关键节点。
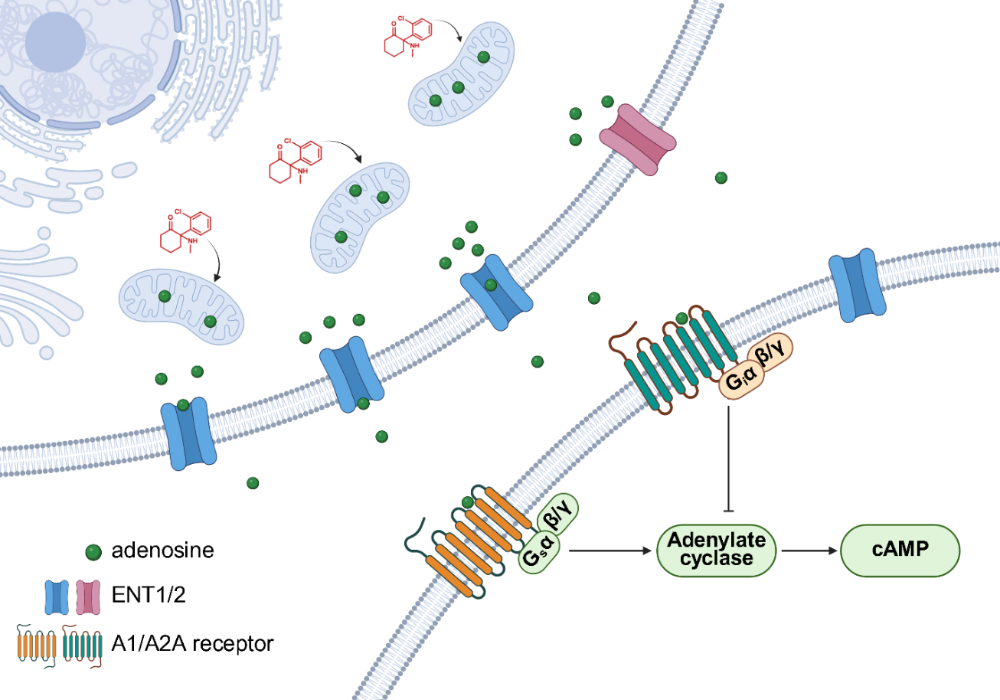
在机制上,研究深入探索了氯胺酮提升细胞外腺苷水平的来源。研究发现,氯胺酮并未引起细胞外ATP/ADP水平的升高,且其效应在CD73敲除小鼠中依然存在,排除了细胞外核苷酸水解是其主要来源的可能性。进一步实验表明,抑制平衡型核苷转运体ENT1/2可显著减弱氯胺酮诱导的腺苷释放,提示其来源为细胞内。利用ATP/ADP比率传感器PercevalHR,研究者观察到氯胺酮能够迅速降低内侧前额叶皮层中兴奋性神经元、抑制性神经元及星形胶质细胞内的ATP/ADP比率,且这一代谢变化在时间上早于细胞外腺苷的升高。体外线粒体代谢流分析显示,氯胺酮在治疗相关浓度下可直接抑制线粒体三羧酸循环的代谢通量。这些证据共同勾勒出一条新通路:氯胺酮通过直接调节细胞能量代谢,增加细胞内腺苷,进而通过核苷转运体释放至细胞外。
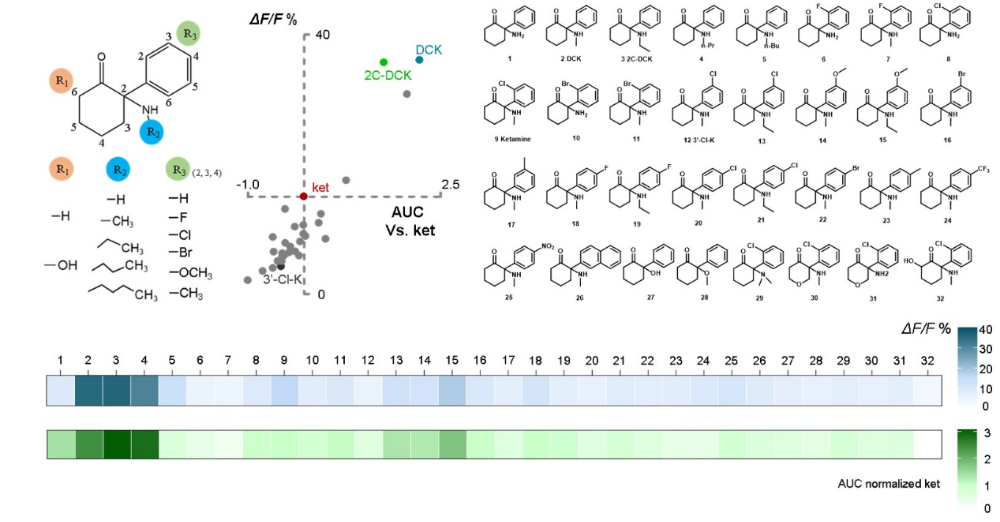
基于对上述机制的深入理解,研究者以“增强腺苷释放”为表型指标,设计并筛选了一系列氯胺酮衍生物。其中,去氯氯胺酮在低剂量下即能诱发更强、更持久的腺苷信号,并在行为学测试中表现出优于氯胺酮的抗抑郁功效,同时其引发的运动亢进副作用显著减弱。值得注意的是,化合物的腺苷释放效能与其对NMDA受体的抑制强度并无显著相关性,提示其抗抑郁作用存在独立于NMDAR抑制的新机制。
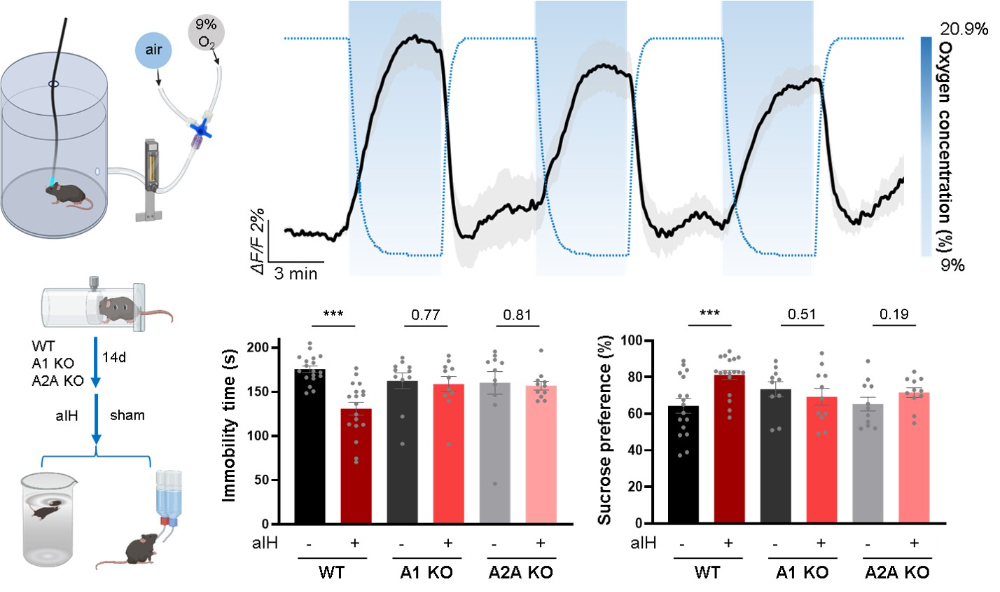
此外,研究者探索了非药物手段提升脑内腺苷的治疗潜力。研究发现,一种可控的急性间歇性低氧干预方案,能够安全地诱发内侧前额叶皮层内的腺苷释放,并在抑郁模型小鼠中产生依赖于A1和A2A受体的快速抗抑郁效应。
综上所述,本研究发现并证实了腺苷信号通路是氯胺酮与电休克治疗产生快速抗抑郁作用的共同关键机制。这一发现不仅深化了我们对快速抗抑郁机制的理解,也为开发新一代基于腺苷信号调控的、副作用更小的抗抑郁策略(包括小分子药物与非药物干预)提供了坚实的理论依据和明确的靶点。
参考文献:Yue, C., Wang, N., Zhai, H. et al. Adenosine signalling drives antidepressant actions of ketamine and ECT. Nature (2025). https://doi.org/10.1038/s41586-025-09755-9
创作声明:本文是在原英文文献基础上进行解读,存在观点偏向性,仅作分享,请参考原文深入学习。


想了解更多内容,获取相关咨询请联系
电 话:+86-0731-84428665
伍经理:+86-180 7516 6076
工程师:+86-180 7311 8029
邮 箱:consentcs@163.com

订购和售后

邮箱:consentcs@163.com
地址:湖南省长沙市高新技术开发区青山路699号湖南省军民融合科技创新产业园8栋B座1609室
微信公众号
Copyright © 康森特生物科技(长沙)有限公司 2024
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。

售前:+86-0731-84228665
+86 -180 7516 6076
售后:+86 -180 7516 7741
传真:+86-0731-84228665


