新闻资讯

2026年1月5日,中南大学谢辉、饶珊珊、陈春媛共同通讯在Nature Aging(IF=19.5)在线发表题为“Brain neuron-derived WDFY1 induces bone loss”的研究论文。文中提到大脑健康与骨骼稳态密切相关,骨骼衰老的特征是骨形成不足和骨髓脂肪堆积,但大脑是否会导致这种失衡尚不明确。此前研究虽发现脑源性因素参与骨重塑,且精神或神经系统疾病患者更易患骨质疏松,但自然衰老的大脑是否通过脑 - 骨轴调控,参与破坏骨微环境、诱导骨髓间充质干细胞(BMSCs)异常向脂肪细胞分化,进而引发骨质疏松,仍缺乏相关证据。
基于此,本研究旨在探究以下核心问题:一是衰老大脑来源的细胞外囊泡(AB-EVs)是否会对骨骼代谢产生影响,引发骨 - 脂肪失衡;二是若存在上述影响,AB-EVs 中发挥关键作用的功能因子是什么;三是该功能因子调控骨骼代谢的具体分子机制;四是通过干预该调控通路,能否改善年龄相关的骨流失和骨质疏松,为临床防治骨骼衰老相关疾病提供新靶点和新思路。
1
研究方法
1 细胞外囊泡(EVs)的分离与鉴定
从不同年龄和基因型小鼠的脑组织中分离年轻大脑来源 EVs(YB-EVs)、衰老大脑来源 EVs(AB-EVs)及对应非 EV 组分,通过透射电子显微镜观察形态,纳米颗粒跟踪分析(NTA)检测粒径和浓度,Western blotting 验证 CD9、CD63 等外泌体标志物的表达,排除非 EV 蛋白污染。同时,从老年和年轻人类供体血浆中分离血浆 EVs(Pla-EVs),用于后续功能验证。
2 动物模型构建与处理
构建多种基因工程小鼠模型,包括 Wdfy1 条件性敲除小鼠(Wdfy1fl/fl)、Rab27b 条件性敲除小鼠(Rab27bfl/fl),并与 Map2-CreERT2 或 Camk2a-CreERT2 小鼠杂交,获得神经元特异性敲除 Wdfy1 或 Rab27b 的小鼠;构建 Tlr3-/- 和 Tlr4-/- 小鼠,用于探究信号通路依赖性。通过脑室内注射、海马注射、静脉注射等方式,给予小鼠 AAV 载体(过表达或沉默 Wdfy1)、EVs、重组 WDFY1 蛋白或 RVG-9R 介导的 siWdfy1 等干预,设置不同性别和年龄组,持续干预后检测骨骼相关表型。
3 细胞实验
分离小鼠骨髓间充质干细胞(BMSCs)和 RAW264.7 破骨前体细胞,进行成骨分化、成脂分化和破骨分化诱导。通过 Alizarin Red S(ARS)染色检测成骨钙结节形成,Oil Red O(ORO)染色检测成脂脂质积累,TRAP 染色鉴定破骨细胞。利用 siRNA 沉默目标基因(如 Vps29、Vps26a、Ctsd 等),或转染重组质粒,探究分子机制。
4 检测与分析技术
采用 microcomputed tomography(μCT)分析骨骼微观结构参数(如骨体积分数、骨小梁数量等);三点弯曲试验检测股骨力学强度;免疫染色(OCN、perilipin 等)检测成骨细胞和脂肪细胞数量;qRT-PCR 检测成骨、成脂相关基因表达;ELISA 检测血清中骨代谢标志物(OCN、CTX-I)、炎症因子及 WDFY1 蛋白水平;蛋白质组学分析 EVs 中差异表达蛋白;免疫共沉淀(Co-IP)和 pull-down 实验验证蛋白相互作用;免疫荧光染色观察蛋白定位与共定位。
5 生物信息学分析
重新分析公共单细胞 RNA 测序(snRNA-seq)数据集,鉴定大脑中 Wdfy1 高表达的细胞类型,量化不同年龄组中 Wdfy1 阳性细胞比例。
2
研究内容
1 AB-EVs 诱导骨 - 脂肪失衡并改变 BMSC 分化命运
透射电子显微镜下,YB-EVs 与 AB-EVs 均呈现典型的球形或杯状结构,纳米颗粒追踪分析检测二者粒径相近,且均表达外泌体特征标志物。经 DIR 标记的 EVs 经脑室内或静脉注射后,可在小鼠骨骼等多个器官检测到荧光信号;Map2-CreERT2; Cd63 报告小鼠实验证实,生理条件下神经元来源的 EVs 可进入骨骼组织。4 月龄年轻小鼠经静脉注射 AB-EVs 后,骨小梁相关骨微结构指标显著降低,股骨力学强度下降,成骨细胞数量减少,骨髓脂肪细胞增多,破骨细胞的数量与活性均显著增强;15 月龄老年小鼠注射 AB-EVs 后,骨流失与骨髓脂肪堆积的表型进一步加重。体外实验结果显示,AB-EVs 可显著抑制 BMSCs 的成骨分化、促进其成脂分化,人类老年血浆来源的 EVs 也呈现出一致的调控效应。
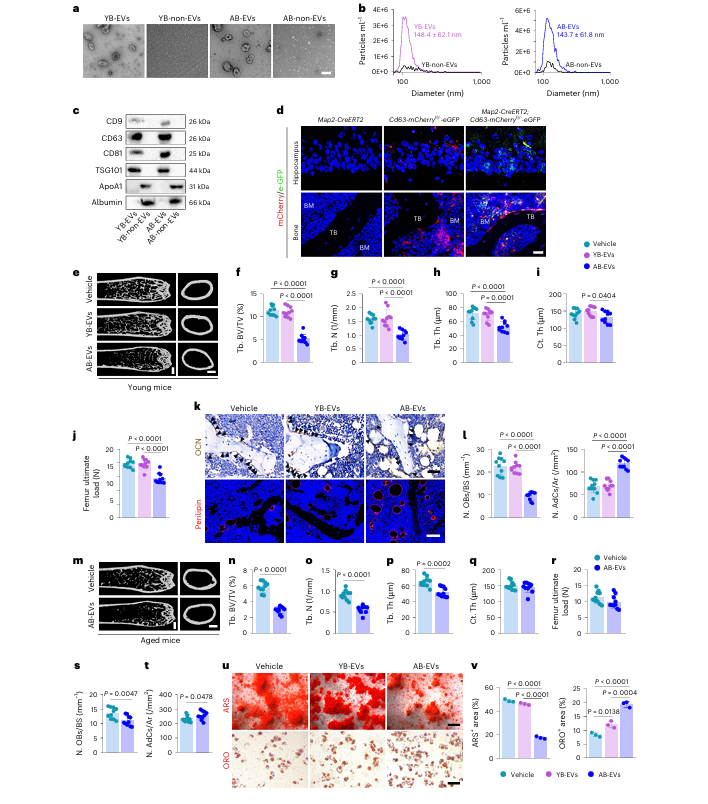
图1 | AB-EVs诱导骨-脂肪失衡并改变 BMSC 分化命运。
2 WDFY1 是 AB-EVs 中调控骨代谢的关键蛋白
蛋白质组学分析发现,AB-EVs 与 YB-EVs 存在多种差异表达蛋白,其中 WDFY1 在 AB-EVs 中呈显著上调趋势。qRT-PCR 与 Western blotting 实验证实,老年小鼠大脑组织中 Wdfy1 的 mRNA 与蛋白表达水平均显著升高,且骨髓组织中 WDFY1 蛋白表达也同步升高,提示骨髓中的 WDFY1 可能由大脑转运而来。体外实验显示,重组 WDFY1 蛋白可直接抑制 BMSCs 成骨分化、促进其成脂分化,下调成骨相关基因表达,上调成脂相关基因表达,且对破骨细胞分化存在剂量依赖性调控作用。ELISA 检测发现,老年小鼠的血清及血清 EVs 中 WDFY1 水平均显著升高,人类老年血浆及血浆 EVs 中 WDFY1 表达水平随年龄增长呈上升趋势,且与骨密度呈负相关关系。
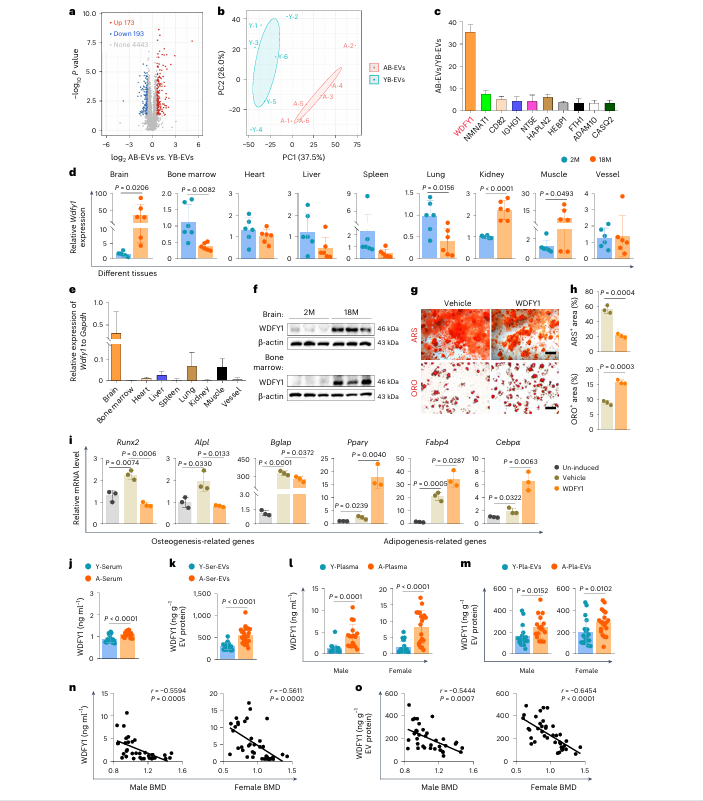
图2 | 抗成骨与促脂肪生成蛋白WDFY1在AB-EVs中富集,且与骨密度(BMD)呈负相
3 大脑 WDFY1 通过 EVs 介导调控骨 - 脂肪失衡
年轻小鼠经脑室内注射 AAV2-Wdfy1 过表达载体后,出现骨量减少、骨力学强度下降,成骨细胞减少、脂肪细胞增多,且组织中炎症因子水平升高的表型;而老年小鼠经脑室内注射 AAV2-shWdfy1 沉默载体后,骨骼的衰老相关表型得到显著改善。从 Wdfy1 沉默小鼠中分离的 AB-EVs,其 WDFY1 蛋白含量显著降低,对 BMSCs 成骨、成脂分化的调控作用也随之减弱。直接向小鼠骨髓内注射 WDFY1 蛋白,或静脉注射过表达 Wdfy1 小鼠的血清 EVs,均可诱导年轻小鼠出现骨流失与骨髓脂肪堆积的表型。在小鼠海马部位注射 Wdfy1 过表达或沉默载体,也观察到相似的骨骼表型改变,证实大脑(尤其是海马区)来源的 WDFY1 可通过 EVs 转运至骨骼,进而调控骨代谢与骨 - 脂肪平衡。
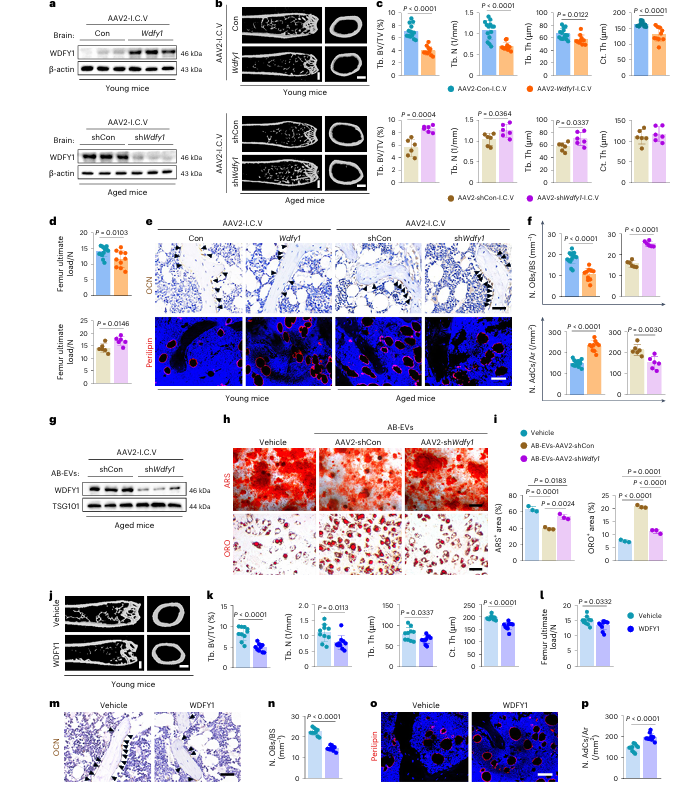
图3 | WDFY1基因在脑部促进骨-脂肪失衡并介导AB-EVs对 BMSC 分化的影响
4 神经元 Wdfy1 缺失或抑制神经元 EV 释放改善骨骼衰老
单细胞核 RNA 测序与免疫荧光染色实验证实,WDFY1 主要在老年小鼠大脑的 MAP2 阳性神经元中高表达,其中海马与大脑皮层的 CAMK2A 阳性神经元为主要表达部位。构建神经元特异性 Wdfy1 敲除小鼠(Map2-CreERT2; Wdfy1fl/fl、Camk2a-CreERT2; Wdfy1fl/fl)后发现,老年敲除小鼠的骨量与骨力学强度显著提升,成骨细胞数量增加,骨髓脂肪细胞减少,组织中炎症因子水平降低。构建神经元特异性 Rab27b 敲除小鼠以抑制神经元 EV 的释放,结果显示其 AB-EV 的产量减少,且 EVs 中 WDFY1 含量降低,小鼠骨骼的衰老相关表型得到显著改善,其 AB-EVs 对 BMSCs 成骨、成脂分化的调控作用也相应减弱。
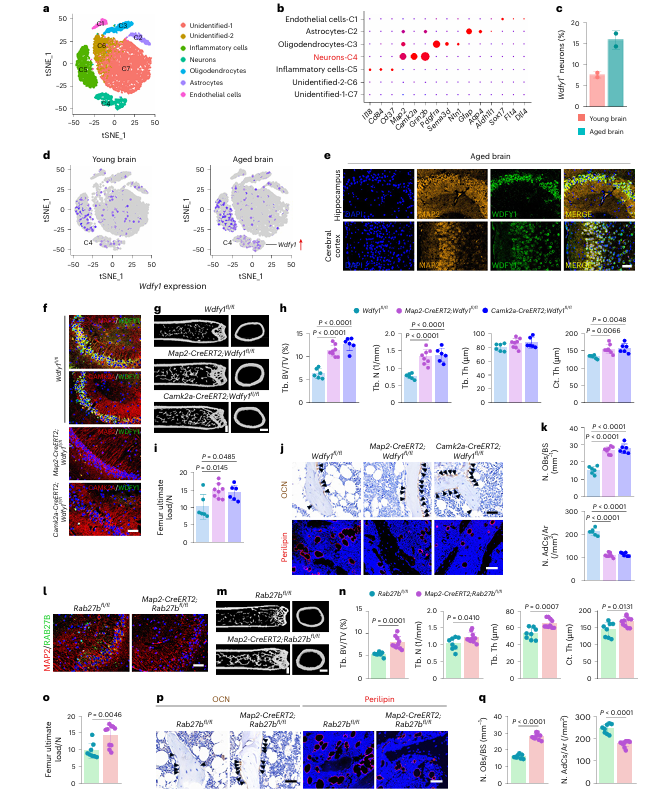
图4 | 神经元Wdfy1缺失或阻断神经元EV分泌可增加骨量并缓解衰老诱导的骨-脂肪失衡。
5 RVG 介导的脑内 siWdfy1 递送改善老年小鼠骨骼健康
利用可穿越血脑屏障并靶向神经元的 RVG-9R 肽递送 siWdfy1,对老年小鼠进行静脉注射处理后,其海马神经元中 WDFY1 的表达被显著抑制,且 RVG-9R-siWdfy1 的抑制效果优于对照肽。骨微结构检测与力学测试结果显示,RVG-9R-siWdfy1 处理组小鼠的骨量与骨强度显著升高,成骨细胞数量增加,骨髓脂肪细胞减少,其 AB-EVs 对 BMSCs 的成骨抑制与成脂促进作用也明显减弱。
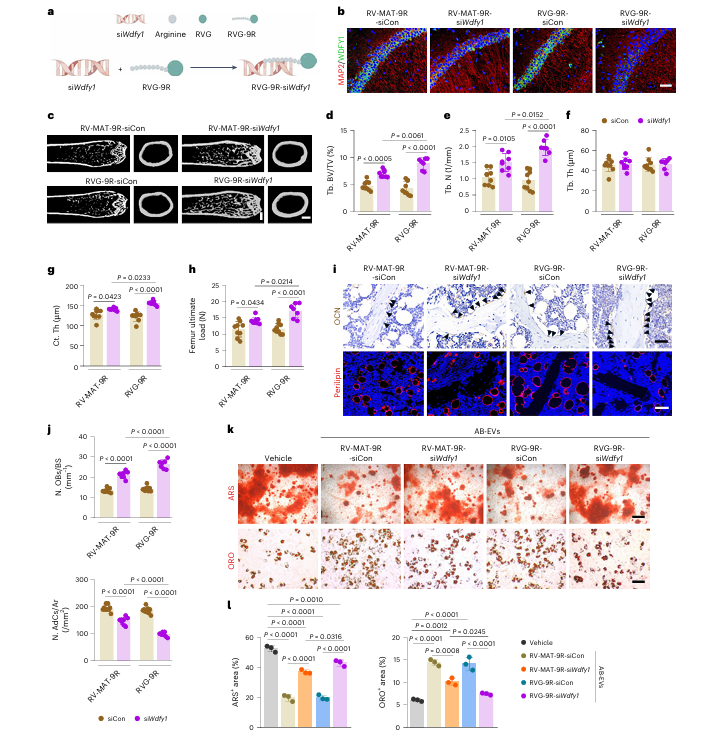
图5 | RVG 介导的siWdfy1脑部递送可改善老年小鼠骨骼健康。
6 WDFY1 通过 retromer 复合体调控 CTSD 和 PRDX2 回收
蛋白质组学与免疫共沉淀实验证实,WDFY1 可与 retromer 复合体的核心组分直接结合。利用 siRNA 沉默 retromer 复合体相关基因后,WDFY1 对 BMSCs 成骨、成脂分化的调控作用被显著抑制。WDFY1 的 WD 结构域缺失突变体丧失了对 BMSC 分化的调控功能,而 FYVE 结构域缺失则对其调控功能无明显影响。进一步研究发现,WDFY1 对 Ctsd 和 Prdx2 的基因表达无明显调控作用,但可通过结合 retromer 复合体,促进二者从内体向高尔基体的回收过程,减少其降解,进而导致两种蛋白在细胞内积累。利用 siRNA 分别沉默 Ctsd 或 Prdx2 后,可分别削弱 WDFY1 对 BMSCs 的成脂促进或成骨抑制作用。免疫共沉淀实验显示,CTSD 可与 retromer 复合体的多种组分结合,PRDX2 也可与 retromer 复合体的特定组分结合。
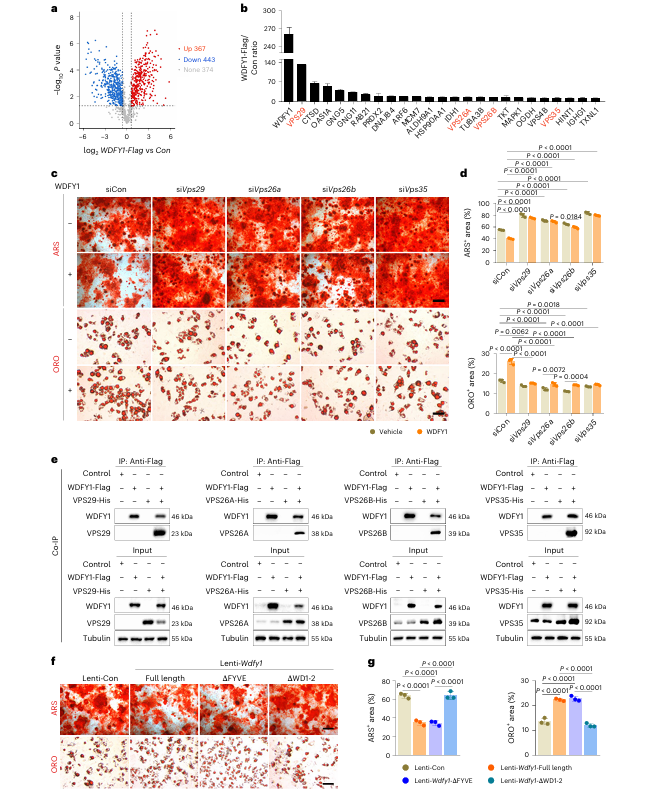
图6 | 逆向转运复合体VPS26A/B-VPS35-VPS29介导WDFY1对骨髓间充质干细胞(BMSCs)的调控作用。
7 WDFY1 的骨损伤作用不依赖 TLR3/4 信号
在 Tlr3 基因敲除与 Tlr4 基因敲除小鼠中,经脑室内注射 AAV2-Wdfy1 过表达载体后,小鼠骨量相关指标仍呈显著降低趋势,表明 WDFY1 对骨代谢的调控作用独立于 TLR3/4 信号通路。
3
创新点
1 揭示衰老大脑神经元 EVs 介导的脑 - 骨调控新通路
首次证实衰老大脑神经元分泌的 EVs 是脑 - 骨轴的关键信使,与年轻大脑 EVs 不同,AB-EVs 可通过转运 WDFY1 蛋白,远程调控骨骼代谢,诱导骨 - 脂肪失衡和骨质疏松,明确了大脑衰老在骨骼衰老中的主动调控作用,突破了传统对脑 - 骨通信方式的认知。
2 鉴定 WDFY1 为骨代谢新调控因子
发现 WDFY1 作为此前未被报道的骨代谢调控蛋白,在衰老大脑神经元中高表达,通过 EVs 转运至骨髓后,发挥抗成骨、促成脂作用,且其在人类血浆和血浆 EVs 中的水平与骨密度呈负相关,为骨质疏松的诊断提供了潜在生物标志物。
4
启发
1 深化脑 - 骨轴研究认知
该研究证实大脑衰老并非被动过程,而是通过 EVs 介导的远程调控主动参与骨骼衰老,提示在研究骨质疏松等年龄相关骨骼疾病时,需充分考虑大脑状态的影响,为从多器官交互角度理解骨骼代谢调控提供了新视角,未来可进一步探索脑 - 骨轴中其他 EVs cargo 的作用。
2 拓展生物标志物与治疗靶点范围
WDFY1 作为与骨密度负相关的蛋白,有望开发为骨质疏松的诊断生物标志物,尤其适用于老年人群或伴有脑功能衰退的患者。同时,WDFY1、retromer 复合体组分或 CTSD/PRDX2 均可作为骨质疏松治疗的潜在靶点,为研发新型抗骨质疏松药物提供了明确方向。
参考文献:Chen CY, Wang Z, Hong CG, Tan YJ, Duan YX, Luo Y, Wang X, Zeng HJ, Luo JY, Wan TF, Yin H, Liu XX, Zhu H, Zhou Y, Wang ZG, He ZH, Hu XY, Hu GW, Lang HL, Wang ZX, Cao J, Rao SS, Xie H. Brain neuron-derived WDFY1 induces bone loss. Nat Aging. 2026 Jan 5. doi: 10.1038/s43587-025-01032-8IF: 19.4 Q1 . Epub ahead of print. PMID: 41491871.
创作声明:本文是在原英文文献基础上进行解读,存在观点偏向性,仅作分享,请参考原文深入学习。


想了解更多内容,获取相关咨询请联系
电 话:+86-0731-84428665
伍经理:+86-180 7516 6076
工程师:+86-180 7311 8029
邮 箱:consentcs@163.com

订购和售后

邮箱:consentcs@163.com
地址:湖南省长沙市高新技术开发区青山路699号湖南省军民融合科技创新产业园8栋B座1609室
微信公众号
Copyright © 康森特生物科技(长沙)有限公司 2024
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。

售前:+86-0731-84228665
+86 -180 7516 6076
售后:+86 -180 7516 7741
传真:+86-0731-84228665


